Borrelia infektion
Agens
Borrelia (B.) burgdorferi sensu lato är samlingsnamnet på en grupp spiralformade bakterier (spiroketer) som orsakar fästingöverförd borreliainfektion, även kallad ”Lyme borrelios” efter orten Lyme i nordöstra USA, där sjukdomen och sambandet med fästingbett beskrevs kliniskt så sent som i slutet av 70-talet. 1982 isolerades borrelia för första gången från Ixodes fästingar och sjukdomsorsaken kunde fastställas. Infektionsbilden finns dock beskriven långt tidigare.
Borrelia burgdorferi komplexet består av ett flertal subtyper, varav fem (B. afzelii, B. garinii, B. burgdorferi sensu stricto, B. bavariensis, B. spielmanii) är säkert humanpatogena och förekommer i Sverige. De två förstnämnda subtyperna (B. afzelii och B. garinii) är de vanligast förekommande.
I USA orsakas Borreliainfektion enkom av B. burgdorferi sensu stricto.
Smittsamhet och spridning i befolkningen och i samhället
Borrelios är en zoonos (vektorburen infektion) och drabbar människa genom att en infekterad fästing borrar sig fast i huden för att suga blod, varvid borreliabakterierna överförs. Infektionen smittar inte mellan människor. I Sverige sprids borrelia av fårfästingar (Ixodes ricinus). Förekomsten av borreliabakterier i fästingar i Sverige varierar stort och är högst (i vissa regioner 30%) i delar av södra och mellersta Sverige.
Genom att ta bort fästingen tidigt (inom 1–2 dygn) kan man minska risken för överföring av borrelia (borreliaspiroketerna behöver förflytta sig från fästingens tarmsystem till spottkörtlarna, vilket tar ca 24–48 h). Antalet fall med symtomatisk borreliainfektion är ej känd, men uppskattas till ca 5000–10 000 per år i Sverige. Merparten av dessa fall har endast symtom från huden (erythema migrans, EM). Eftersom Borreliainfektion inte är en anmälningspliktig sjukdom är incidensen osäker.
Klinisk bild
Sjukdomsbilden kan indelas i tre stadier, beroende av inkubationstid och lokalisation (lokal eller disseminerad; var god se nedan). Det innebär inte att alla infekterade personer genomgår samtliga stadier. Spontanläkning förekommer sannolikt också, men säker statistik beträffande frekvens saknas. Utöver de tre stadierna kan postinfektiösa restsymtom efter neuroborrelios och ledinfektioner kvarstå under en kortare eller längre tid efter behandlad infektion. I Sverige är EM den vanligaste manifestationen av borreliainfektion, följt av neuroborrelios, som utgör den vanligaste formen av bakteriell CNS-infektion i Sverige. De olika borreliasubtyperna ger delvis upphov till olika symtom (sannolikt beroende på skillnad i vävnadstropism). B. afzelii är oftast förknippad med tidiga (EM) eller sena (acrodermatitis chronica atrophicans = ACA) hudsymtom, medan B. garinii och B. bavariensis (mera invasiv) orsakar främst neurologiska symtom. B. burgdorferi sensu stricto ger upphov till samtliga kliniska manifestationer utom ACA, och är den enda förekommande subtypen i USA. B. miyamotoi, som tillhör en annan grupp borreliabakterier (återfallsfeber-borrelia), ger bl.a. symtom som återkommande feber, huvudvärk, led- och muskelvärk och kan också ge upphov till infektion i nervsystemet.
Tidig lokaliserad infektion: EM är en växande ringformad hudrodnad ofta med central blekhet, och är det mest klassiska symtomet vid en borreliainfektion. Inkubationstiden efter fästingbettet är ca 7–14 dagar. Kort efter bettet förekommer ofta en liten rodnad (”bettreaktion”) som kvarstår under några dagar efter det att fästingen tagits bort. Denna rodnad kan lätt misstolkas som hudinfektion. Om hudrodnaden fortsätter att växa efter två dygn och blir större än 5 cm bör EM misstänkas och antibiotikabehandling inledas. Allmänsymtom såsom feber, led- och muskelvärk kan även förekomma. Endast hos ca 10–15 % av fallen beräknas obehandlad EM följas av disseminerad infektion. En annan mindre vanlig tidig, lokal manifestation av borreliainfektion är lymfocytom: en värmeökad, rodnad och svulstig förändring lokaliserad till örsnibb, bröstvårta eller pungen och är vanligast hos barn.
Tidig disseminerad infektion: Neuroborrelios, är den vanligaste formen av disseminerad borreliainfektion i Sverige. Inkubationstiden från bettet är ca 7–90 dagar. Kortvarig feber kan förekomma initialt, men andra vid bakteriell meningit vanliga symtom (nackstyvhet, fotofobi, kraftig huvudvärk) saknas i regel. Ett viktigt tidigt symtom hos vuxna är svår neuralgisk smärta (radikulit) ofta lokaliserad i rygg eller extremiteter. Smärtan är ofta mest uttalad nattetid, ibland i kombination med brännande domningar i huden. Facialispares (ansiktsförlamning) ses i upp till hälften av fallen med neuroborrelios. Risken för ansiktsförlamning ökar om fästingbettet är lokaliserat på övre delen av kroppen. Andra manifestationer av spridd borreliainfektion är multipla EM och kardit (hjärtmuskelinfektion) med varierande AV-block.
Sen infektion: Borreliaartrit (ofta migrerande svullnad och rodnad i en eller några stora leder) uppkommer som ovanlig kronisk manifestation i Europa, men är däremot vanligt förekommande i USA. ACA är en utbredd akral blåröd hudrodnad med hudatrofi (papyrusliknade tunn hud), förekommer ibland tillsammans med artrit och perifer polyneuropati och som vanligtvis uppkommer månader till år efter fästingbettet. Neuroborrelios med lång symtomduration och med progressiv encefalopati, vaskulit och myelit förekommer numera mycket sällan.
Restsymtom: Diverse restsymtom (koncentrationssvårigheter, trötthet, led- och muskelvärk, huvudvärk, nedstämdhet, sömnrubbning med mera) efter behandlad borreliainfektion förekommer med stor variation, huvudsakligen efter neuroborrelios och artrit. Orsaken till symtomen är sannolikt multifaktoriell. Flertalet studier har inte lyckats påvisa tecken till kvarvarande borreliainfektion hos dessa patienter. Dessutom har kontrollerade, prospektiva läkemedelsstudier kunnat visa att läkning (vävnadsskador, inflammation) fortgår under lång tid och att antibiotika inte förbättrar restsymtomen. Borreliaspiroketen är känslig för de rekommenderade antibiotikapreparaten (se nedan). Riskfaktorer för att utveckla restsymtom har identifierats: ålder> 40 år, kvinnligt kön, neuroborrelios med radikulit, långdragen (>6 veckor) obehandlad neuroborrelios med kraftig pleocytos samt höga borreliaspecifika antikroppsnivåer i likvor.
Infektion hos den gravida kvinnan
Symtomen vid borreliainfektion hos den gravida kvinnan skiljer sig inte från den kliniska bilden hos icke-gravida. I en europeisk studie av gravida kvinnor med EM, som jämfördes med åldersmatchade icke-gravida kvinnor med EM, angav de gravida kvinnorna signifikant färre symtom associerade med EM jämfört med icke-gravida. Uppkomst av graviditetskomplikationer bedömdes inte ha en association till borreliainfektion.
Infektion hos fostret och det nyfödda barnet
Risken för att det ofödda barnet skall skadas av borreliainfektion under graviditeten förefaller ytterst liten, förutsatt att behandling inleds vid tecken till aktiv infektion.
En systematisk sammanställning publicerad 2018 av studier med fokus på borreliainfektion under graviditet publicerade 1985–2017 kunde inte visa något säkerställt samband mellan aktiv borreliainfektion hos den gravida kvinnan och uppkomst av fosterskada. Sammanställningen kunde inte heller bekräfta ett samband mellan fosterskada, organmissbildningar, spontan abort eller fosterdöd och graviditetslängd vid tidpunkt för aktuell borreliainfektion. I sammanställningen inkluderades studier med fynd av borreliaspiroketer i placenta och i fostervävnad som tecken på vertikal transmission, men fynden kunde inte kopplas till sjukdom eller död hos fostret.
Sammanfattningsvis bedöms risken för fosterskada vid maternell borreliainfektion vara mycket låg.
Överföringsrisk
Transmission av Borrelia burgdorferi genom placenta har dokumenterats såväl hos människa som i djurförsök. Frekvensen av överföring är okänd. Avsaknaden av inflammatoriska tecken hos det ofödda barnet i kombination med resultat från prospektiva studier av maternell borreliainfektion (se punkt 5) talar emot att fostret riskerar att skadas eller påverkas negativt av moderns borreliainfektion.
Laboratoriemetoder
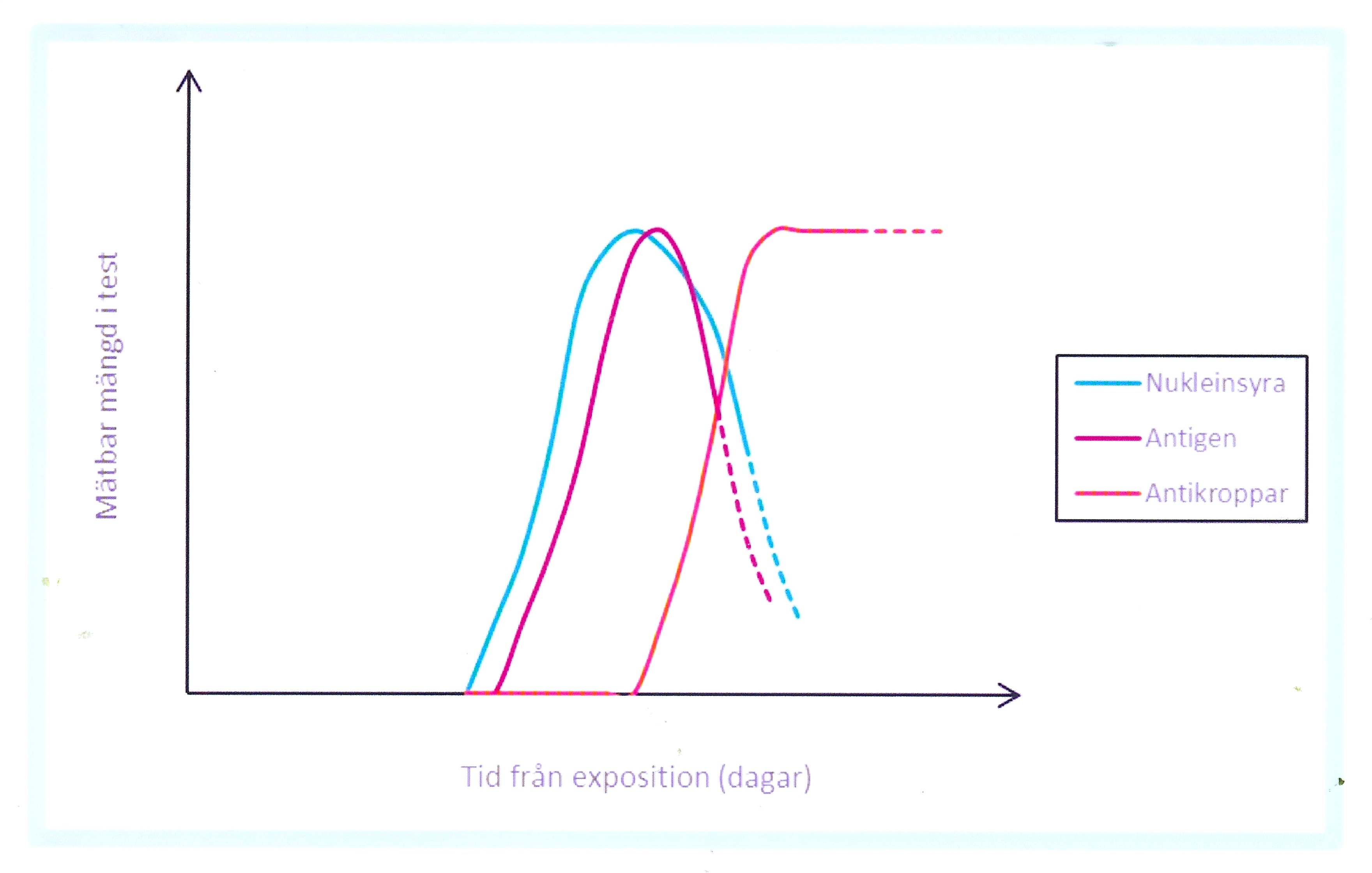
EM är en klinisk diagnos. Färre än hälften av patienter med EM utvecklar borreliaantikroppar (serokonversion). Antikroppsanalys tillför således ingen ytterligare information utan kan snarare försvåra handläggningen!
Vid misstanke om neuroborrelios bör lumbalpunktion utföras för analys av antalet vita blodkroppar i likvor och borreliaspecifik intratekal antikroppsproduktion (IgM och IgG) genom analys av samtidigt taget serum- och likvorprov. Chemokinen CXCL13 är inte borreliaspecifik, men uppnår oftast mycket höga nivåer i likvor tidigt vid neuroborrelios och kan i kombination med mononukleär pleocytos användas som ett stöd för diagnosen (intratekal borreliaantikroppssyntes kan utfalla negativ i tidigt skede). Både neuroborrelios, kardit och lymfocytom ger vanligtvis positivt utfall i serologi efter 6–8 veckors symtomduration. Samtliga patienter med ACA och artrit har positiv serologi (IgG). Påvisning av borrelia med PCR i hud eller ledvätska har tämligen god sensitivitet och kan användas som komplement.
Efter genomförd behandling skall borreliaserologin inte kontrolleras om, eftersom antikropparna både i serum och likvor kan kvarstå under lång tid och nivåerna inte avspeglar behandlingsresultatet.
Tolkning av serologiska resultat kan erbjuda svårigheter. Isolerad IgM förekomst återspeglar inte nödvändigt aktuell borreliainfektion, utan kan vara falsk positivt. Vid kvarstående klinisk misstanke om aktuell borreliainfektion kan ett uppföljande serumprov tas efter 3–4 veckor för att påvisa eventuell serokonversion. Förekomst av IgG-antikroppar är inte alltid förenligt med aktuell infektion, eftersom borreliaspecifikt IgG ofta förekommer hos befolkningen i endemiska områden (seroprevalens) som tecken på tidigare exposition och kvarstår ofta mycket lång tid.
Diagnos av moderns infektion
Diagnos av den gravida kvinnans infektion skiljer sig inte från gängse rekommendationer för icke-gravida vuxna. Var god se punkt 7. Dock rekommenderas kontakt med infektionskonsult vid andra symtom än EM för råd om behandling. Se punkt 11 nedan.
Diagnos av fostrets/barnets infektion
Erfarenhet av intrauterin diagnostik saknas.
Profylax
Vaccin mot borrelia tillhandahålls för närvarande inte. Klinisk prövning pågår för närvarande med nytt vaccin mot borrelia.
Bästa sättet att skydda sig mot smitta är att skydda sig mot fästingbett och att tidigt plocka bort fästingar från huden. Se vidare information från Folkhälsomyndigheten och Läkemedelsverkets publikationer, sök på Fästing och Borrelia. Dessutom finns det information på 1177 Vårdguiden.
Terapi
Inga kontrollerade studier av borreliabehandling hos gravida
finns publicerade. Borreliainfektion under graviditet bör med några
få undantag behandlas som borreliainfektion hos icke-gravida.
Läkemedelsverket utgav 2018 behandlingsrekommendationer för kutan
borreliainfektion hos barn och vuxna, medan rekommendation för
gravida finns i Läkemedelsverkets sammanställning från 2009.
Doxycyklin och övriga tetracykliner är kontraindicerade från och
med andra trimestern, men kan användas vid behandling under första
trimestern.
För patienter med neuroborrelios eller annan disseminerad borrelios under graviditetens andra och tredje trimester och verifierad typ 1-allergi mot penicillin ges ceftriaxon eftersom det inte finns någon risk för korsallergi mellan penicillin och tredje generationens cefalosporiner.
|
Svenska erfarenheter
Prospektiva undersökningar i Sverige av borreliainfektion under graviditet saknas. Enstaka fall finns beskrivna; alla med gynnsam utgång hos barnet.
Handläggning
- Vid vistelse i naturen rekommenderas i möjligaste mån hudtäckande klädsel på nedre extremiteter, regelbunden inspektion av kroppen och omedelbar borttagning av fästingar.
- Indikation saknas för screening eller provtagning av borreliaantikroppar hos gravid, symtomfri kvinna.
- Fästingbett utan tecken på borreliainfektion bör inte utredas med antikroppsanalys eller behandlas profylaktiskt. Däremot är hög uppmärksamhet och tidig antibiotikabehandling vid tecken på borrelios hos den gravida kvinnan viktig.
- EM är en klinisk diagnos. Blodprov ska inte tas! Antibiotikabehandling sker på kliniska grunder (se ovan under terapi). Samråd gärna med infektionskonsult, i synnerhet vid borreliainfektion i senare delen av graviditeten. Efter genomförd behandling skall borreliaserologi inte utföras eftersom antikroppsnivåerna inte avspeglar behandlingsresultatet.
- Vid misstanke om neuroborrelios skall serologisk provtagning och likvoranalys utföras samtidigt! Vid neuroborrelios och andra former av disseminerad borreliainfektion bör utredning ske skyndsamt och antibiotikabehandling insättas utan dröjsmål (se ovan under terapi). Kontakta gärna infektionsklinik för råd.
Referenser
o Steere AC, Grodzicki RL, Kornblatt AN, Craft JE, Barbour AG, Burgdorfer W et al. The spirochetal etiology of Lyme disease. N Engl J Med 1983;308:733-40.
o Balmelli T, Piffaretti JC. Association between different clinical manifestations of Lyme disease and different species of Borrelia burgdorferi sensu lato. Res Microbiol. 1995;146:329-40.
o Parola P, Raoult D. Ticks and tickborne bacterial diseases in humans: an emerging infectious threat. Clin Infect Dis. 2001;3:897-928.
o Ornstein K, Berglund J, Nilsson I, Norrby R, Bergstrom S. Characterization of Lyme borreliosis isolates from patients with erythema migrans and neuroborreliosis in southern Sweden. J Clin Microbiol. 2001;39:1294-8.
o Fryland L, Wilhelmsson P, Lindblom P, Nyman D, Ekerfelt C, Forsberg P.l Low risk of developing Borrelia burgdorferi infection in the south-east of Sweden after being bitten by a Borrelia burgdorferi-infected tick. Int J Infect Dis. 2011;15(3):174-81.
o Berglund J, Eitrem R, Ornstein K, Lindberg A, Ringer A, Elmrud H, Carlsson M, Runehagen A, Svanborg C, Norrby R. An epidemiologic study of Lyme disease in southern Sweden. N Engl J Med 1995;333:1319-27.
o Gustafson R, Jaenson TG, Gardulf A, Mejlon H, Svenungsson B. Prevalence of Borrelia burgdorferi sensu lato infection in Ixodes ricinus in Sweden. Scand J Infect Dis. 1995;27:597-601.
o Wilhelmsson P, Fryland L, Lindblom P, Sjöwall J et al. The risk of a borrelia infection after a tick-bite. Abstract submitted to XII International Jena Symposium on tick-borne diseases.
o Stanek G, Fingerle V, Hunfeld KP, Jaulhac B, Kaiser R et al. Lyme borreliosis: clinical case definitions for diagnosis and management in Europe. Clin Microbiol Infect2011;17:69-79.
o Wormser GP, Dattwyler RJ, Shapiro ED, Halperin JJ, Steere AC, Klempner MS et al. The clinical assessment, treatment and prevention of Lyme disease, human granulocytic anaplasmosis, and babesiosis: clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis2006;43:1089-134.
o Sjöwall J, Ledel A, Ernerudh J, Ekerfelt C, Forsberg P. Doxycycline-mediated effects on persistent symptoms and systemic cytokine responses post-neuroborreliosis: a randomized, prospective, cross-over study. BMC Infect Dis 2012;12:186.
o Henningsson AJ, Malmvall BE, Ernerudh J, Matussek A, Forsberg P. Neuroborreliosis – an epidemiological, clinical and healthcare cost study from an endemic area in south-east of Sweden. Clin Microbiol Infect2010;16:1245-51.
o Ljöstad U, Mygland A. Remaining complaints 1 year after treatment for acute Lyme neuroborreliosis; frequency, pattern and risk factors. Eur J Neurol2010;17:118-23.
o Hansen K, Lebech AM.The clinical and epidemiological profile of Lyme neuroborreliosis in Denmark 1985-1990. A prospective study of 187 patients with Borrelia burgdorferi specific intrathecal antibody production. 1992 Apr;115 ( Pt 2):399-423.
o Elliott DJ, Eppes SC, Klein JD. Teratogen update: Lyme disease. Teratology 2001;64:276-81.
o Larson C, Andersson M, Guo B et al. Complications of pregnancy and transplacental transmission of relapsing-fever borreliosis. J Infect Dis 2006;194:1367-74.
o Weber K, Bratzke HJ, Neubert U, Wilske B, Duray PH. Borrelia burgdorferi in a newborn despite oral penicillin for Lyme borreliosis during pregnancy. Pediatr Infect Dis J. 1988;7:286-9.
o Nadal D, Hunziker UA, Bucher HU, Hitzig WH, Duc G. Infants born to mothers with antibodies against Borrelia burgdorferi at delivery. Eur J Pediatr. 1989;148:426-7.
o Strobino BA, Williams CL, Abid S, Chalson R, Spierling P. Lyme disease and pregnancy outcome: a prospective study of two thousand prenatal patients. Am J Obstet Gynecol 1993;169:367-74.
o Williams CL, Strobino B, Weinstein A, Spierling P, Medici F. Maternal Lyme disease and congenital malformations: a cord blood serosurvey in endemic and control areas. Paediatr Perinat Epidemiol. 1995;9:320-30.
o Strobino B, Abid S, Gewitz M. Maternal Lyme disease and congenital heart disease: A case-control study in an endemic area. Am J Obstet Gynecol. 1999;180:711-6.
o Gerber MA, Zalneraitis EL. Childhood neurologic disorders and Lyme disease during pregnancy. Pediatr Neurol. 1994;11:41-3.
o Maraspin V, Ruzic-Sabljic E, Pleterski-Rigler D, Strle F. Pregnant women with erythema migrans and isolation of borreliae from blood: course and outcome after treatment with ceftriaxone. Diagnostic Microbiol Infect Dis 2011;71:446-448.
o Mylonas I. Borreliosis during pregnancy: A risk for the unborn child? Vector-borne and zoonotic dis. 2011;11:891-8.
o Hercogova J, Vanousova D. Syphilis and borreliosis during pregnancy. Dermatol Therapy2008;21:205-9.
o Lakos, A, Solymosi N. Maternal Lyme borreliosis and pregnancy outcome. Int J Infect Dis2010; 14:494-8.
o Läkemedelsbehandling av borreliainfektion – ny rekommendation 2009.https://www.lakemedelsverket.se/sv/behandling-och-forskrivning/behandlingsrekommendationer/antibiotika-vid-borreliainfektion--behandlingsrekommendation
o Gardner, T. Lyme Disease. Infections diseases of the fetus & newborn infant. Remington JS & Klein JO. 5th ed. Eds. Philadelphia: WB Saunders Company; 2001:519-641.
o Halperin J, Shapiro E, Logigian E, Belman A, Dotevall L, Wormse G, Krupp L, Gronseth G, Bever CT. Practice Parameter: Treatment of nervous system Lyme disease (An evidence-based review) A Report of the Quality Standards Subcommittee of the American Academy of Neurology." J Neurology. 2007 Jul 3;69(1):91-102. Epub 2007 May 23
o Bildmaterial: http://meduni09.edis.at/eucalb/cms/images/stories/images-medical.htm#em
o Senel M, Rupprecht TA, Tumani H, Pfister HW, Ludolph AC, Brettschneider J. The chemokine CXCL13 in acute neuroborreliosis. J Neurol Neurosurg Psychiatry.2010 Aug;81(8):929-33.
o Waddel L et al. A systematic review on the impact of gestational Lyme disease in humans on the fetus and newborn. PLoS ONE 2018; 13(11):e0207067.
o Maraspin V, Lusa L, Blejec T, Ružić-Sabljić E, Pohar Perme M, Strle F. Course and Outcome of Erythema Migrans in Pregnant Women. J Clin Med. 2020 Jul 24;9(8):2364. doi: 10.3390/jcm9082364. PMID: 32722090; PMCID: PMC7463612.
Sökord: borrelia, graviditet
Uppdaterad: 2023-09-23